Syntetické oligonukleotidy jsou krátké řetězce RNA nebo DNA nejčastěji o počtu 15 až 100 jednotek nukleotidů. Mají široké využití v oblasti výzkumu, v genetice i ve forensních vědách. Tato skupina sloučenin zahrnuje i malé interferující RNA, terapeutické antisense oligonukleotidy, aptamery a CRISPR vodící RNA (CRISPR guide)[1]. Tyto látky se vyrábějí synteticky, často s modifikací základní kostry nebo cukru na 2´pozici kvůli stabilitě a farmakologickým účinkům.
Syntéza oligonukleotidů je poměrně složitý proces, kdy při jednotlivých cyklech vzniká řada vedlejších produktů. Při vývoji a výrobě těchto látek je proto nezbytná podrobná charakterizace nečistot i cílového produktu a jeho purifikace. Charakterizace oligonukleotidů zahrnuje potvrzení jejich molekulové hmotnosti, sekvence nukleotidů, čistoty finálního oligonukleotidu a relativní kvantifikace specifických nečistot. V tomto článku se dozvíte, jaké nástroje nabízí společnost Agilent pro tuto oblast.
HPLC separace oligonukleotidů
Chromatografická separace oligonukleotidů se provádí metodami HPLC, nicméně samotná analýza skrývá řadu nástrah. Oligonukleotidy jsou poměrně polární a především obsahují mnoho záporně nabitých fosfátových funkčních skupin. Separace na běžné reverzní fázi není vhodná z důvodu malé retence. LC separace se proto provádí na silných anexech (SAX) 1,2 anebo pomocí iontopárové chromatografie na reverzní fázi (IP-RP)3,4, s triethylaminem jako nejběžnějším iontově párovým činidlem, což je metoda potenciálně kompatibilní i s hmotnostně spektrometrickou detekcí.
Problémem je, že iontopárové činidlo zůstává dlouho v celém LC/MS systému a jeho použití není vhodné v laboratořích, kde je MS detektor využíván i pro jiné aplikace, především v režimu pozitivní ionizace. V nedávno publikovaných aplikačních poznámkách byla s úspěchem použita i separace na chromatografii s hydrofilní-lipofilní interakcí HILIC5,6, při které se iontopárové činidlo nepoužívá.
Přítomnost velmi polárních fosfátových skupin také vede k negativním sorpčním jevům v běžných HPLC systémech, které obsahují nerezové komponenty. Proto je vhodnější využívat (U)HPLC systémy z ušlechtilých slitin bez přítomnosti železa, které se označují jako biokompatibilní popř. bioinertní. Agilent pro tuto analýzu přímu doporučuje systém 1290 Infinity II Bio ve variantě UHPLC (1300 bar) nebo Prime (800 bar) a kolony série AdvanceBio.
Stanovení čistoty oligonukleotidů
Získání vysoce čistých syntetických oligonukleotidů není snadné. Platí, že s délkou řetězce cílové molekuly klesá výtěžnost výroby a zvyšuje se podíl nečistot. Nečistoty vzniklé při syntéze zahrnují molekuly s kratším nebo naopak delším nukleotidovým řetězcem, nekompletní thiolací, případně se ztrátou bází. K dalším nečistotám patří produkty konverze fosforothioátů na fosfodiestery, produkty oxidace, enzymové nukleázové degradace nebo nečistoty s přítomností chránících skupin, používaných ve výrobě.
Pro stanovení čistoty oligonukleotidů nabízí Agilent dvě ucelená řešení pomocí metod LC/UV nebo LC/MS, viz Obrázek 1. Co se týče MS detektoru, je zde dostačující jednoduchý kvadrupól popřípadě TOF MS, který lze zároveň využít pro profilování nečistot diskutované v následujícím odstavci.
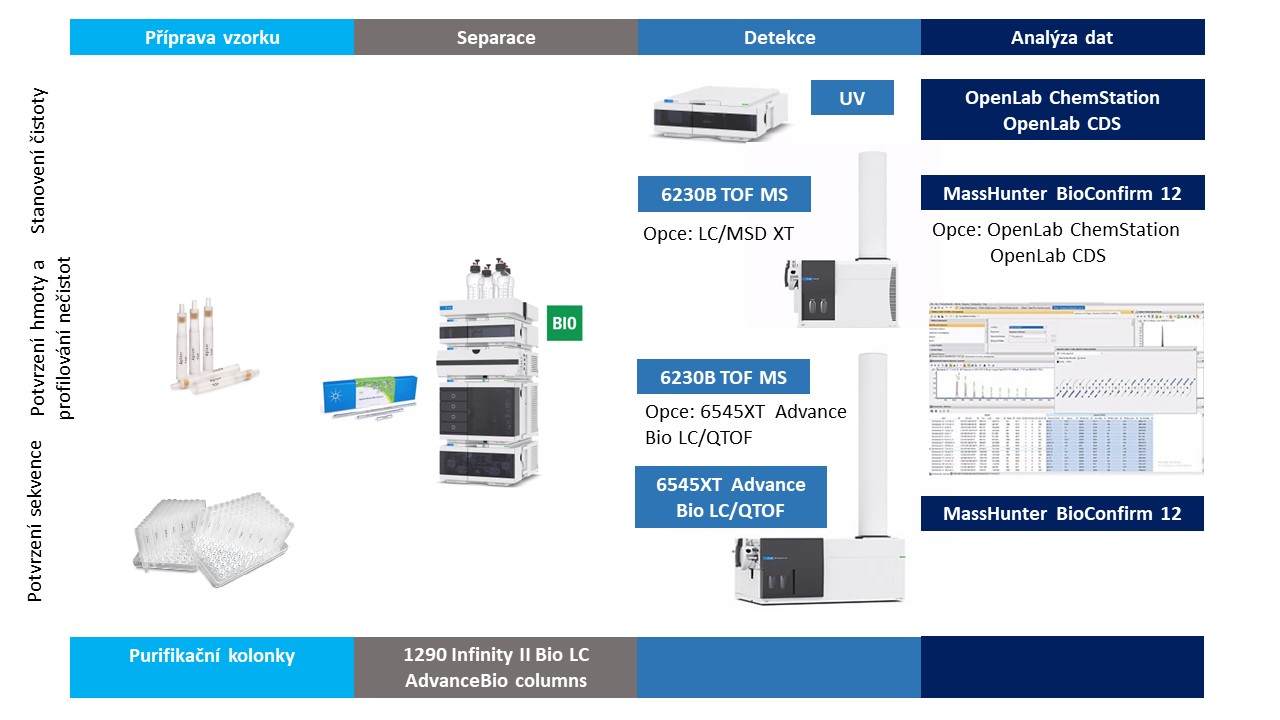
Potvrzení hmoty produktu a profilování nečistot
Podrobná charakterizace vzorku obnáší nejen potvrzení hmoty cílového oligonukleotidu, ale také identifikaci a relativní kvantifikaci nečistot. Vzhledem k rozmanitosti potenciálních nečistot a jejich stopovému množství vůči hlavnímu produktu potřebujeme při profilování nečistot pokročilé analytické metody jako je LC/MS. Zároveň se v rutinní analýze neobejdeme bez pokročilých softwarových nástrojů pro automatické zpracování a interpretaci výsledků. Software Agilent MassHunter BioConfirm 12 umožňuje analýzu dat pro potvrzení hmoty cílového oligonukleotidu a stanovení souvisejících nečistot (Target Plus Impurities, TPI). Tento postup využívá MS dat bez fragmentace, která lze měřit na jednoduchém TOF MS detektoru Agilent 6230B. Obrázek 2 znázorňuje tento postup. Na Obrázku 3 je ilustrace zobrazení výsledků této analýzy v software BioConfirm. Podrobnosti naleznete v aplikační poznámce 7.
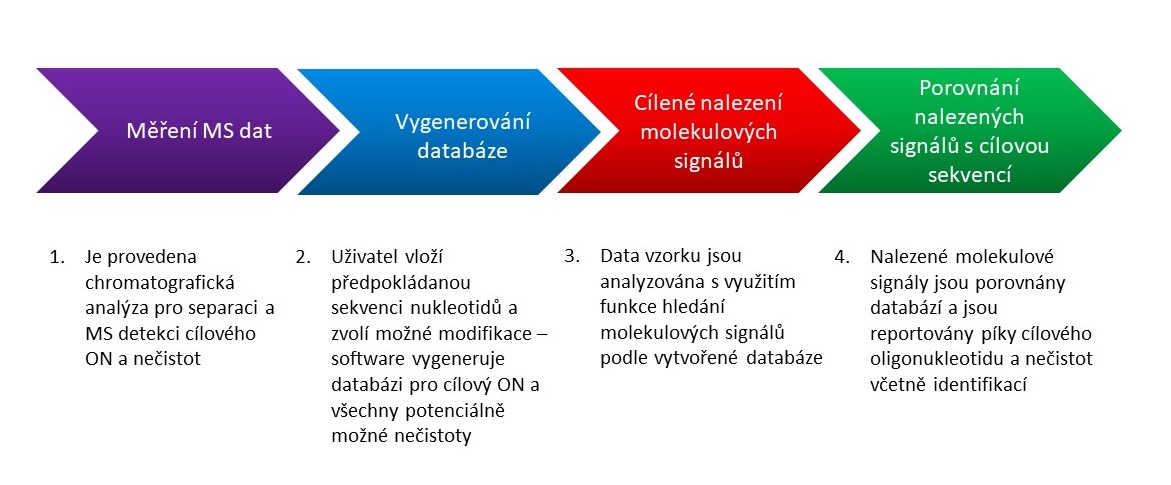
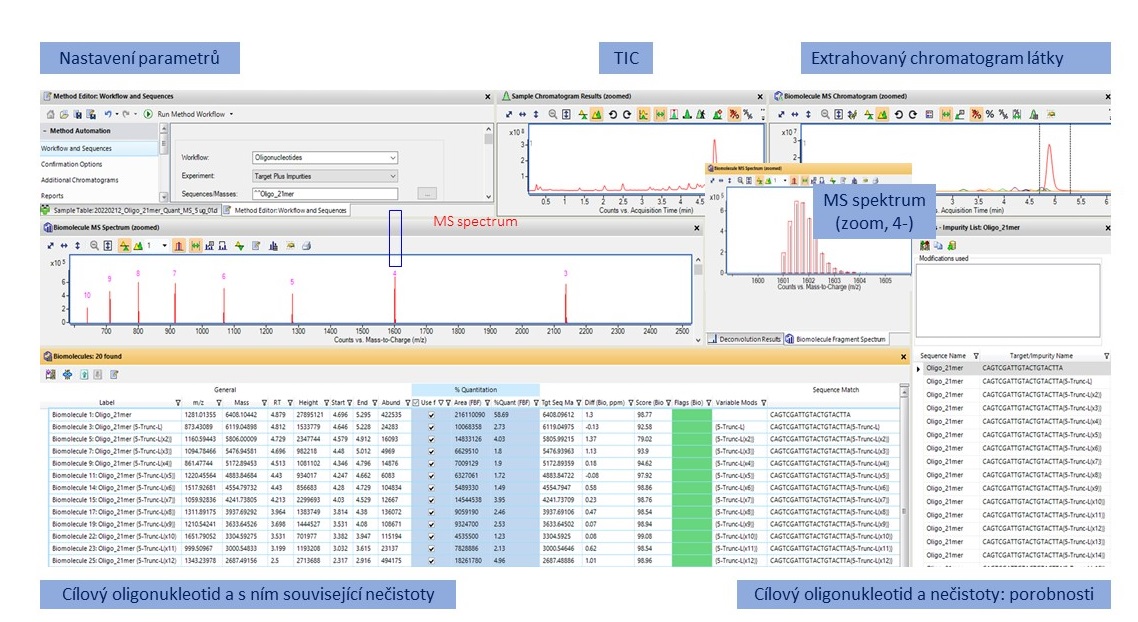
Konfirmace sekvence oligonukleotidu
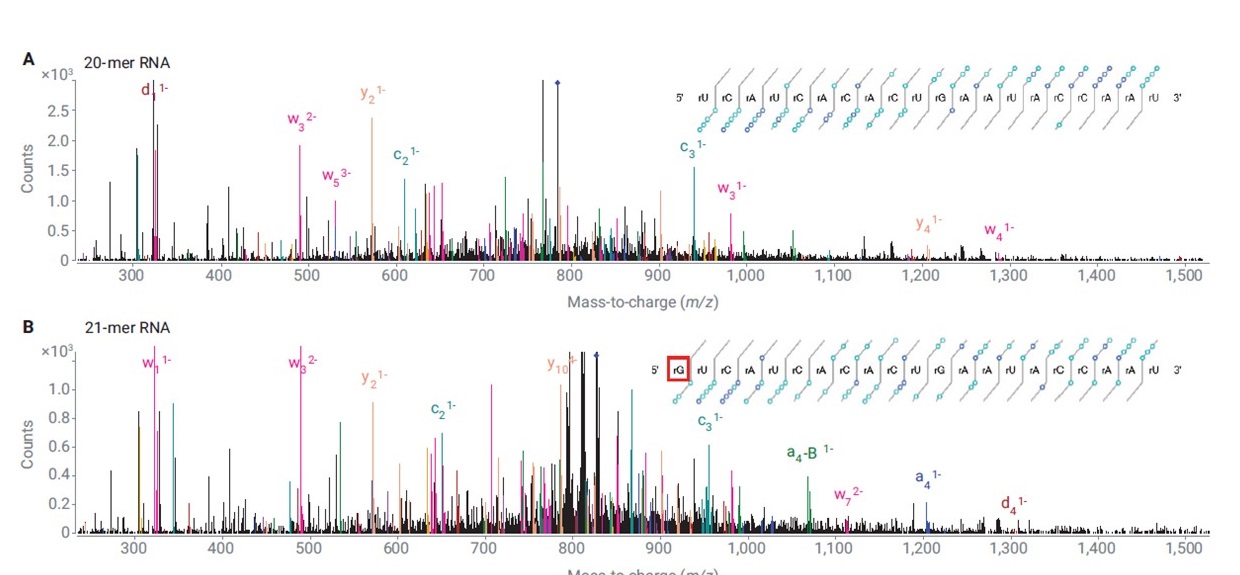
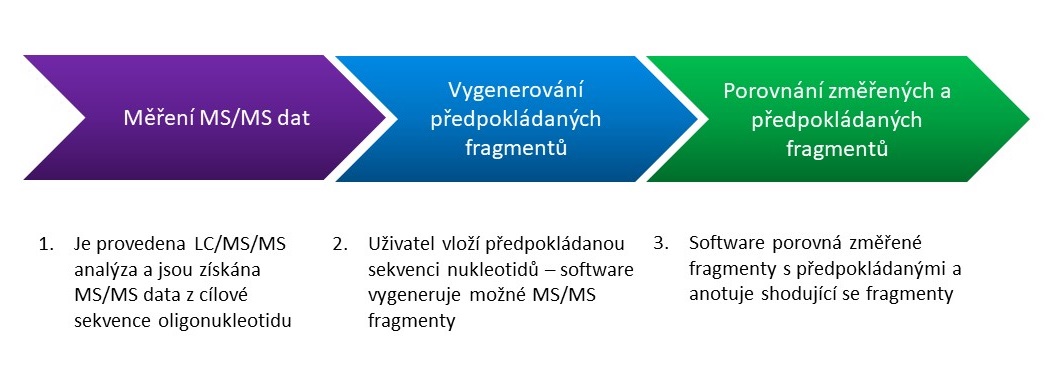
Pro konfirmaci sekvence oligonukleotidu se pro cílový oligonukleotid změří MS/MS data s vysokým rozlišením a přesnou hmotou systémem LC/QTOF MS. Software MassHunter BioConfirm 12 potom „namapuje“ tato MS/MS data na předpokládané fragmenty vypočtené z uživatelem zadané sekvence nukleotidů a odpoví na otázku, jak dobře se shoduje skutečná sekvence s tou předpokládanou (pokrytí sekvence, sequence coverage). To je možné díky tomu, že z oligonukleotidové sekvence mohou vznikat pouze určité typy fragmentů – viz Obrázek 4. Software BioConfirm vypočte sumární vzorce všech předpokládaných fragmentů z dané sekvence, tyto fragmenty potom cíleně hledá v MS/MS spektru a zobrazí jejich detekci na tzv. Fragment confirmation ladder. - viz Obrázek 4. Na základě toho je kvantifikováno pokrytí sekvence (viz Obrázek 5) a jsou zjištěny strukturní modifikace sekvence i v situaci, že celková molekulová hmotnost je identická. Postup pro konfirmaci sekvence oligonukleotidu naleznete na schematu v Obrázku 6. Podrobnosti naleznete v aplikační poznámce8.
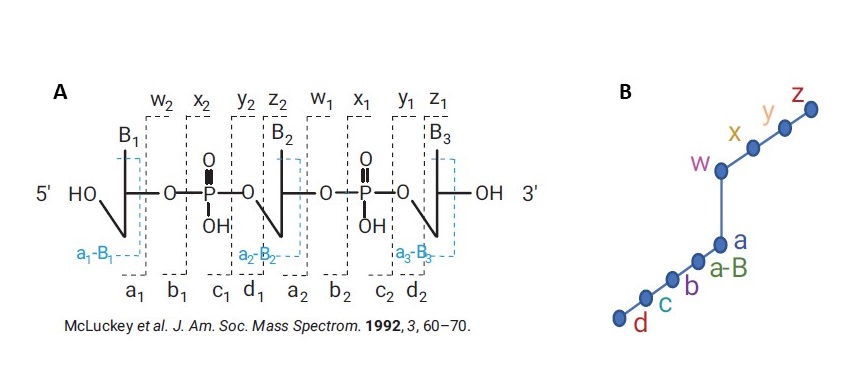
Purifikace oligonukleotidů
Kromě portfolia pro analýzu oligonukleotidů nabízí Agilent také celé řešení pro jejich purifikaci. Uživatel může volit purifikační systém v širokém rozsahu od analytického měřítka až po preparativní. Kromě samotné instrumentace jsou k dispozici také kolony, software a hotové metody 9-11. Preparativní systémy jsou samozřejmě v bioinertním nebo biokompatibilním provedení jako Agilent 1260 Infinity II Bio-Inert nebo 1290 Infinity II Bio LC.
[1] CRISPR je nedávno objevená technika genetického inženýrství, kterou lze modifikovat genomy živých organismů. Do buňky se dodá nukleasa Cas9 spojená se syntetickou vodicí RNA (gRNA) a genom buňky je možné štěpit na požadovaném místě.
Literatura:
1. Jordy Hsiao et al.: Optimizing Separation of Oligonucleotides with Anion‑Exchange Chromatography, Agilent aplikační poznámka 2022
2. J. Massi et al.: High Resolution Separations of Oligonucleotides using PL-SAX Strong Anion-Exchange HPLC Columns, Agilent aplikační poznámka 2021
3. Phu Duong et al.: Fast and High-Resolution Reversed-Phase Separation of Synthetic Oligonucleotides, Agilent aplikační poznámka 2017
4. Gerd Vanhoenacker et al.: Evaluation of Different Ion-Pairing Reagents for LC/UV and LC/MS Analysis of Oligonucleotides, Agilent aplikační poznámka 2021
5. Peter Rye et al.: MS1 Oligonucleotide Characterization Using LC/Q-TOF with HILIC Chromatography, Agilent aplikační poznámka 2023
6. Guannan Li et al.: MS/MS Oligonucleotide Sequencing Using LC/Q-TOF with HILIC Chromatography, Agilent aplikační poznámka 2023
7. David L. Wong et al.: An Integrated Workflow for the Analysis of Oligonucleotides and Their Impurities by Agilent High-Resolution LC/(Q-)TOF Mass Spectrometry Separation, characterization, and relative quantitation of target oligonucleotides and their impurities, Agilent aplikační poznámka 2022
8. David L. Wong et al.: Comprehensive and Integrated Workflow for Oligonucleotide Sequence Confirmation by Agilent High-Resolution LC/Q-TOF, Agilent aplikační poznámka 2022
9. Florian Rieck et al.: Fast and Selective Purification of Oligonucleotides Using Preparative HPLC/MS and Software Support, Agilent aplikační poznámka 2022
10. Oligonucleotide Purification using Ion Pair Reversed-Phase Liquid Chromatography, Agilent Consumables Workflow Ordering Guide
11. Oligonucleotide Purification using Anion Exchange Liquid Chromatography, Agilent Consumables Workflow Ordering Guide





