V analýze reziduí pesticidů a farmak v potravinách nebo v životním prostředí jsou běžné LC/MS metody obsahující stovky analytů. Není zase tak známý fakt, že podobné nebo i větší cílené metody se s úspěchem uplatňují také v „life science“ výzkumu. I když se často využívají necílené „omics“ přístupy s využitím hmotnostních spektrometrů s vysokým rozlišením a přesnou hmotou (HRAM), řada vědců dává přednost právě cíleným metodám, které zahrnují mnoho důležitých analytů, jako jsou metabolity, lipidy nebo peptidy. Hlavními výhodami je relativně snadná interpretace dat a jejich zasazení do biologického kontextu, ale samozřejmě i lepší detektabilita analytů, vyšší přesnost a menší pravděpodobnost falešně pozitivních nebo falešně negativních výsledků. Pokrok v instrumentaci trojitých kvadrupólů, především jejich citlivost a schopnost kvantitativně stanovit stovky látek v jedné metodě, umožňuje v současné době daleko větší rozvoj cílených „omics“ přístupů.
V tomto článku se zaměříme na nejnovější LC/MS trojitý kvadrupól Agilent 6495D a v jeho druhé části také na kompletní metodiky pro cílenou metabolomiku, lipidomiku a proteomiku.
Agilent LC/MS trojitý kvadrupól 6495D
Jde o nový nejvyšší model trojitého kvadrupólu Agilent s technologií iFunnel 4. generace. Konstrukce jednotlivých elementů tohoto přístroje byla vyvinuta s ohledem na dosažení špičkových parametrů pro kvantitativní analýzu, jako jsou meze kvantifi kace, lineární rozsah, reprodukovatelnost, rychlost a robustnost.

Detektabilita ruku v ruce s robustností
Design vstupní části hmotnostního spektrometru zahrnuje ortogonální elektrosprej s vyhřívaným koaxiálním plynem. Ionty vstupují do vakuové části přes kapiláru, jejíž otvor má větší průměr než u ostatních modelů, a tak se dostává více iontů do hmotnostního spektrometru. Před kontaminací je vstupní kapilára chráněna krytkou (spray shield). Za kapilárou jsou mimoosé iontové nálevky „iFunnel“, kde dochází k fokusaci paprsku iontů, eliminaci neutrálního šumu a k přestupu iontů do vyššího vakua. Konstrukce iontových nálevek je přitom optimalizována s ohledem na maximální transmisi iontů širokého rozsahu m/z. U přístroje Agilent 6495D je nově možno nastavit parametry iFunnel samostatně pro jednotlivé přechody s ohledem na charakter analytu. Například pro nestabilní analyty nebo nižší m/z potřebujeme šetrnější podmínky iontové optiky, aby nedocházelo k rozpadu těchto látek ještě před prvním kvadrupólem. Jde o poměrně častý problém třeba u látek s karboxylovou skupinou (ztráta CO2 ) nebo u sekundárních alkoholů (ztráta vody za vzniku dvojné vazby). Analogicky lze pro konkrétní MRM přechod nastavit optimální podmínky pro transmisi velkých molekul.
Zahnutá a zužující se kolizní cela fokusuje vznikající produktové ionty a maximalizuje jejich vstup do druhého kvadrupólu. Zároveň je eliminován neutrální šum spolu s rychlým vyprázdněním kolizní cely pro další ionty, takže se zcela eliminuje tzv „cross-talk“.
Výše zmíněné součásti hardware v kombinaci s dalšími elementy iontové optiky a detektorem iontů tvoří vyladěnou kombinaci, jejímž výsledkem je vysoká citlivost přístroje, aniž by tím byla obětována jeho robustnost a dlouhodobá stabilita signálu i v případě analýzy v komplikovaných matricích. Srovnání detektability pro pesticidy v obtížných matricích ve srovnání s předchozím modelem 6495C je znázorněno na obr. 2.
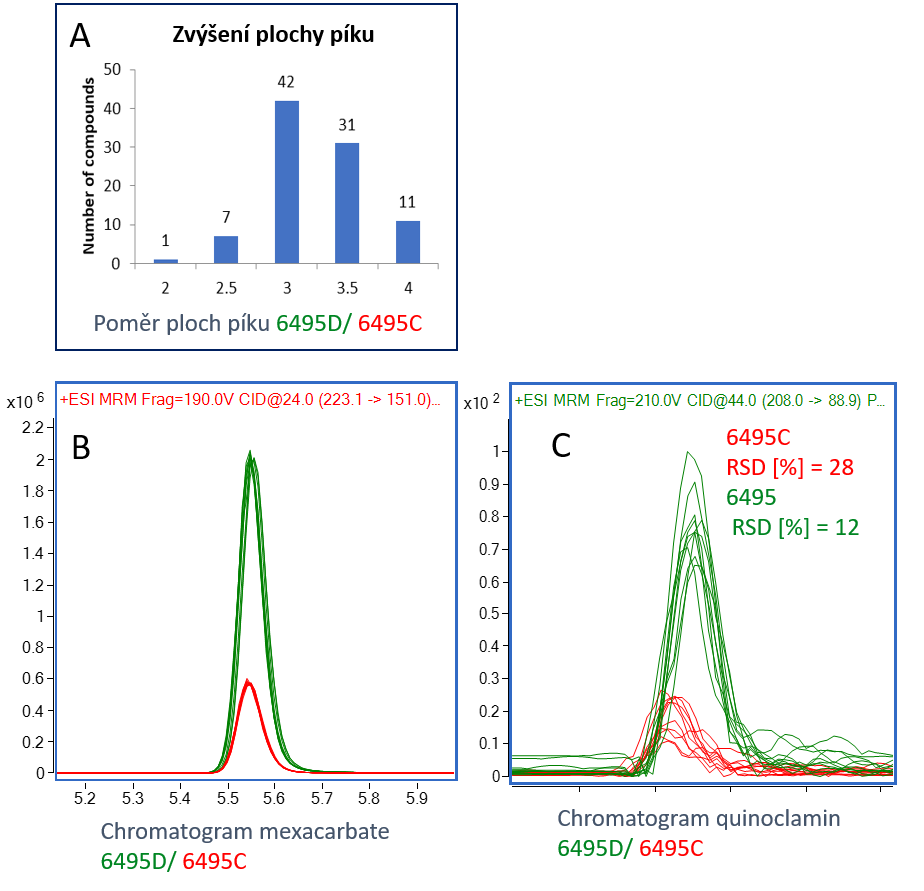
A – Histogram zvýšení plochy píku pro 92 pesticidů. Pro většinu analytů se plocha zvýšila 3–4 x;
B – Porovnání chromatogramů pesticidu mexacarbate, LOQ je 3,4 x nižší pro 6495D;
C – Porovnání chromatogramů pesticidu quinoclamin, LOQ je 4,1 x nižší pro 6495D.
Rychlost měření pro rozsáhlé metody
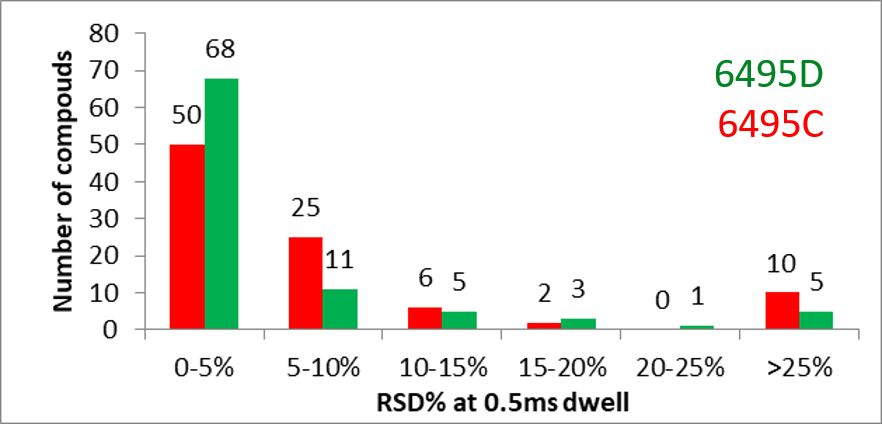
Pro metody s velkým počtem analytů a zároveň s přepínáním polarity ionizace je vysoká rychlost měření stěžejní. V nejnovějším trojitém kvadrupólu Agilent 6495D byla vylepšena elektronika ovládající frekvenční napětí iontových nálevek, díky čemuž došlo ke zvýšení rychlosti sběru MRM přechodů až na 700 MRM/s. Praktická měření ukazují velmi dobrou reprodukovatelnost a citlivost i za podmínek velmi nízkých dwell time. Příklad je vidět na obr. 3.
Rozsah m/z vás neomezí
Elementy vstupní iontové optiky jsou zodpovědné nejen za přenos iontů do vakua, ale také ovlivňují m/z rozsah hmotnostního spektrometru. Vstupní optika musí účinně transportovat jak ionty s nízkým, tak i vysokým m/z. U nejcitlivějších LC/MS trojitých kvadrupólů se právě kvůli kompromisu mezi transmisí iontů a rozsahem m/z často setkáme s omezením horní hranice hmotnostního rozsahu okolo m/z 2000, někdy i nižším. Díky patentovanému designu iFunnel nemusí Agilent volit mezi citlivostí a rozsahem m/z, proto LC/MS systém 6495D disponuje ve své kategorii zcela unikátním hmotnostním rozsahem až do m/z 3000. To jej předurčuje pro náročné aplikace i v oblasti větších molekul, jako jsou peptidy nebo některé lipidy.
Snadné čištění vstupní optiky
I přes všechna opatření se samozřejmě stane, že je čas od času potřeba vyčistit iontový zdroj a vstup iontů do MS. Všechny nové hmotnostní spektrometry Agilent jsou vybaveny izolačním ventilem „VacShield“ pro možnost čištění vstupní kapiláry bez vypínání a zavzdušnění přístroje, viz obr. 4.

B – Vyjmutí kapiláry je usnadněno použitím speciálního nástroje.
Přístrojová inteligence
Agilent 6495D se připojil do rodiny „inteligentních“ LC/MS. Ve spolupráci s novým akvizičním SW Agilent MassHunter 12 tak nabízí celou řadu nových vlastností a funkcí:
- Ladění SWARM (= angl. roj včel) je multiparametrový iterační algoritmus optimalizace prvků iontové optiky, díky němuž je společné optimum nalezeno rychleji a kvalitněji.
- Upozornění na včasnou údržbu (Early Maintainance Feedback, EMF) a autodiagnostika.
- Funkce Inteligentní Refl ex zajišťuje podmíněnou logiku nástřiků. Sekvence se může automaticky upravit podle výsledků předchozí analýzy.
- Automatická optimalizace MRM přechodů a parametrů iontového zdroje je nyní nedílnou součástí MassHunter 12 akvizičního SW. Optimalizace probíhá automaticky opakovanými nástřiky z vialky, což je výhodnější oproti ladění z infuze díky výrazně nižší spotřebě (často drahých) standardů, a také nedochází ke zbytečné kontaminaci systému cílovými analyty. V případě použití chromatografi cké kolony algoritmus naladí i látky se stejnou hmotou prekurzoru, které se chromatograficky separují.
Cílená metabolomika
Agilent vyvinul kompletní postup, který kombinuje přípravu vzorků na robotické platformě Agilent Bravo a jejich měření na systému Agilent 1290 Infi nity II Bio LC a trojitém kvadrupólu 6495. Metoda obsahuje také databázi optimalizovaných MRM přechodů pro 500 metabolitů, zahrnující i polární molekuly, jako jsou aminokyseliny, koenzymy, trikarboxylové kyseliny a produkty glykolýzy.
Příprava vzorku je realizována na Agilent Bravo metabolomické platformě ve formátu jamkových destiček. Ve vzorcích plazmy nebo buněčného lyzátu se nejprve precipitují proteiny, které se následně spolu s lipidy odstraní na SPE destičce se sorbentem Agient Captiva EMR Lipid. Vzorky se odpaří (mimo robot) a vrací se do Agilent Bravo na rekonstituci do finálního rozpouštědla.
K chromatografické separaci se využívá Agilent 1290 Infi nity II Bio LC s kolonou Poroshell 120 HILIC-Z. Biokompatibilní UHPLC systém je vyroben ze slitiny MP35N, která neobsahuje železo a její inertnost leží hned za titanem. Mechanická a tlaková odolnost je stejná jako u standardního UHPLC z nerezové oceli. Na Bio LC systému lze dosáhnout dobrého tvaru píku a reprodukovatelného měření i pro chromatografi cky problematické analyty interagující s kovy, jako jsou aminokyseliny, polykarboxylové kyseliny a fosforylované metabolity – viz obr. 5.
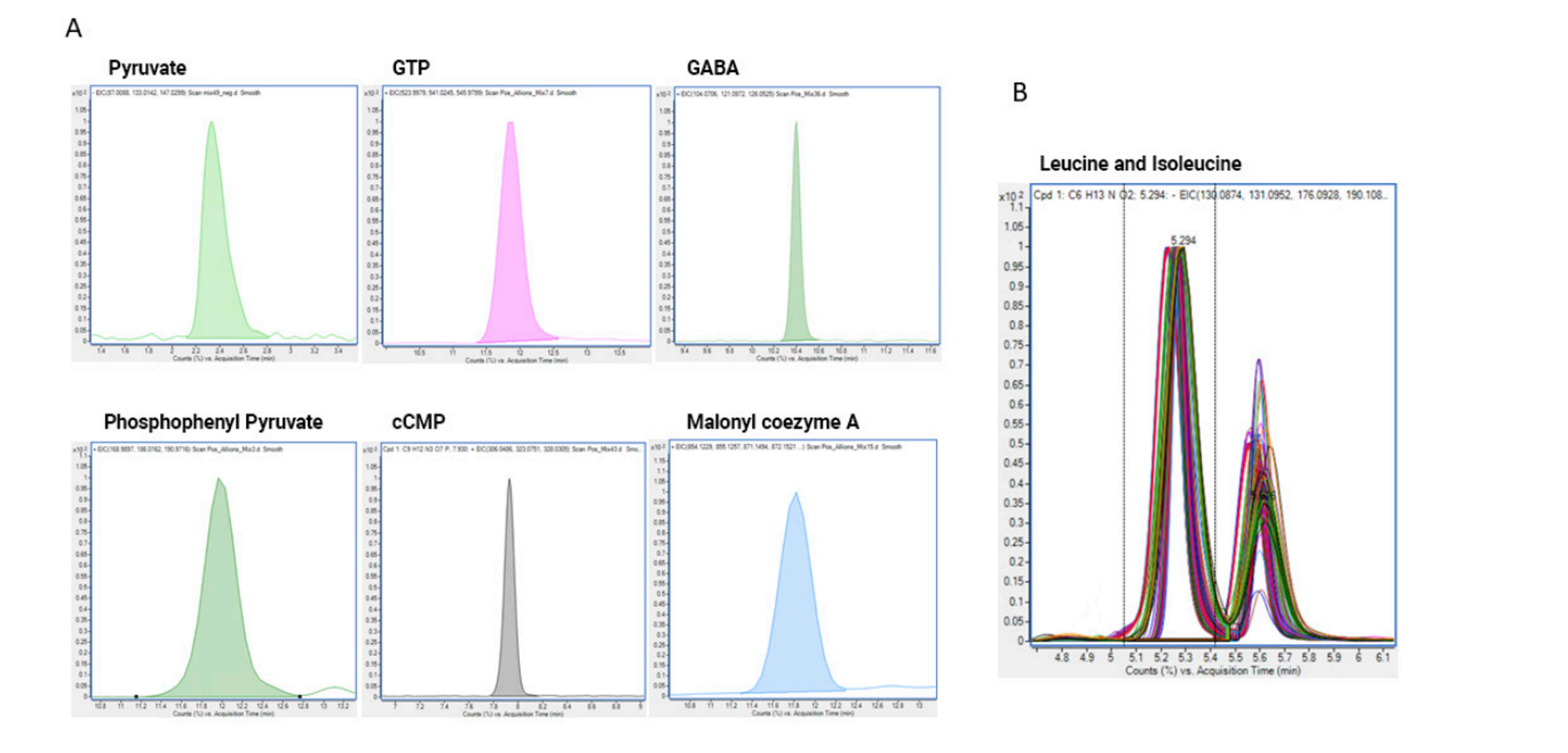
B – Separace a opakovatelnost retenčních časů leucinu a isoleucinu, překryv chromatogramů ze 160 nástřiků extraktů plasmy
Pro detekci je použit hmotnostní spektrometr Agilent 6495 a metabolomická databáze zahrnující 500 látek s plně optimalizovanými MRM přechody. Validace metody ukázala, že kvantitativní a citlivá detekce metabolitů je možná už při dwell time okolo 1 ms, což umožňuje i profi lování všech 500 metabolitů. Lze zvolit různé přístupy k měření: a) profi lování všech metabolitů na 1 MRM přechodu; b) profi lování užší skupiny cílených metabolitů na více přechodech; c) kvantitativní analýza s využitím izotopově značených standardů od Cambridge Isotope Laboratories. Kompletní popis metabolomického řešení je v aplikační poznámce od společnosti Agilent [1].
Cílená lipidomika
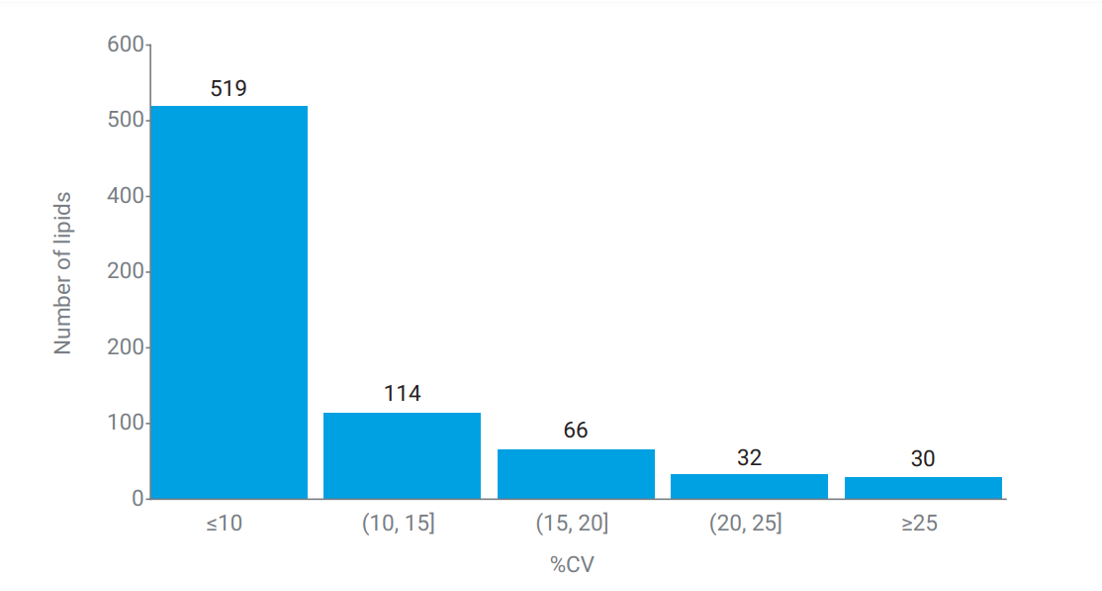
Profi lování lipidů je další z aplikací, kdy je nezbytné změřit velké množství analytů v jedné analýze. Agilent ve spolupráci s Baker Heart and Diabetes Institute v Melbourne vyvinul řešení pro cílenou lipidomiku, umožňující cílené stanovení 763 lipidů z extraktu plasmy s celkovou dobou analýzy 16 min. Příprava vzorku se provádí extrakcí směsí butanol-metanol (1:1) s přídavkem 10 mM mravenčanu amonného, přičemž do extrakčního rozpouštědla je přidána směs vnitřních standardů. Analytická metoda zahrnuje separaci na koloně s reverzní fází Agilent Zorbax Eclipse Plus C18 a detekci pomocí LC/MS trojitého kvadrupólu 6495. Akviziční metoda využívá dynamické MRM s přepínáním polarity a zahrnuje 763 lidských lipidů z 44 tříd. Podobně jako v metabolomické metodě, i tato měřicí metoda je velmi náročná na rychlost hmotnostního spektrometru, v nejfrekventovanější oblasti chromatogramu se měří 115 přechodů současně, což vede k dwell time nižšímu než 2 ms. I za těchto podmínek jsou získána kvantitativní data, jak je patrné z histogramu relativních směrodatných odchylek na obr. 6.
Kompletní popis uvedené lipidomické metody je v aplikační poznámce [2] a v publikaci [3].
Cílená proteomika
Proteomická příprava vzorku, podobně jako u metabolomiky, může být plně automatizována na robotické platformě Agilent Bravo, která nabízí předpřipravené postupy pro jednotlivé kroky přípravy vzorku nebo jejich kombinaci (například zakoncentrování proteinů, enzymatická hydrolýza, přečištění peptidů…).
Řešení pro cílenou proteomiku Agilent zahrnuje citlivé a kvantitativní stanovení proteinů PeptiQuant kitu (MRM proteomics) zahrnující 270 proteinů lidské plazmy [4]. Metoda je založena na UHPLC separaci za standardních průtoků s iontovým zdrojem Agilent Jet Stream. Měření na systémech se standardním průtokem je oproti nano LC systémům vhodnější pro studie s velkými počty vzorků, a to jak z hlediska robustnosti systému, tak i významně lepší propustnosti vzorků díky kratšímu času analýzy.
Díky vysoké citlivosti trojitého kvadrupólu Agilent 6495 a schopnosti měřit velký počet MRM přechodů v jedné metodě je dosaženo mezí kvantifi kace srovnatelné s nano LC technikou ve spojení s HRMS v režimu monitoringu paralelních reakcí (PRM), přičemž linearita a opakovatelnost dosahovaná na Agilent LC/MS QQQ systému je lepší [5].
Pro rozsáhlé klinické studie, kde je kladen důraz na malou spotřebu vzorku a na standardizované robustní řešení, je možné využít také spojení nano LC Evosep One s Agilent 6495 trojitým kvadrupólem. Tato „high- -throughput“ metoda využívá automatického rychlého odsolení vzorku ve špičce se sorbentem a následující gradientová eluce přenese peptidy z této špičky na nanoLC kolonu [7]. Narozdíl od klasického nano LC jsou gradienty rychlejší, doba analýzy kratší a systém je významně robustnější.
Pro vývoj metod a vyhodnocení dat slouží software Skyline, který je plně integrován s Agilent MassHunter SW.
Závěr
Nový Agilent 6495D opět zvedl pomyslnou laťku přístrojů typu LC/MS trojitého kvadrupólu z hlediska výkonu a uživatelských funkcí. Možnost měření velkého počtu látek v metodě s vynikající opakovatelností a citlivostí i za podmínek velmi nízkých dwell time spolu s odolností matriční zátěži předurčují tento přístroj k využití v cílených „omics“ metodách. Agilent v posledním roce uvedl předpřipravené postupy a LC/MS metody pro cílenou metabolomiku, lipidomiku a proteomiku s využitím tohoto nejvyššího modelu LC/MS trojitého kvadrupólu. Laboratoř tak může ušetřit zdlouhavý vývoj metod a daleko rychleji tak být připravená na rutinní měření vzorků.
Literatura
[1] Karen E. Yannell et al., An end-to-end targeted metabolomics workfl ow, Agilent aplikační poznámka 2023.
[2] Kevin Huynh et al., A comprehensive, curated, high throughput method for the detailed analysis of the plasma lipidome, Agilent aplikační poznámka 2021.
[3] Kevin Huynh et al., High-throughput plasma lipidomics: Detailed mapping of the associations with cardiometabolic risk factors, Cell Chem. Biol. 2019, 26(1), 71–84.e4.
[4] Linfeng Wu et al., Peptide quantifi cation in plasma using the Agilent 6495 triple quadrupole LC/MS coupled with the Agilent 1290 Infi nity II LC System, Agilent aplikační poznámka 2020.
[5] Nicolas Eskenazi et al., Quantifi cation of Frataxin-M Protein, a blood biomarker of the rare disease Friedreich’s Ataxia using the Agilent 6495 triple quadrupole LC/MS system, Agilent aplikační poznámka 2023.
[6] Linfeng Wu et al.,Robust and Reproducible Protein Quantifi cation in Plasma using the Evosep One and the Agilent 6495 Triple Quadrupole LC/MS, Agilent aplikační poznámka 2023.
Pro více informací neváhejte kontaktovat produktového specialistu Jitku Zrostlíkovou, jitka.zrostlikova@hpst.cz
Článek byl také publikován v CHEMGAZÍN 2/2024





